«Mouvement Molécule" existe sous la forme d'une variété de composants. Le mouvement de translation des molécules comme des unités complètes dans l'espace en trois dimensions est un composant majeur. D'autres composants comprennent les rotations et les vibrations de la totalité ou une partie d'une molécule. Ce type de mouvement moléculaire est explicable par la théorie de la thermodynamique classique.
Energie total
Molécules peuvent être visualisées sous forme de très petits, boules de billard élastiques. Si une personne est titulaire d'une boule de billard jusqu'à à hauteur d'épaule, la boule de billard ne se déplace pas, mais il a le potentiel de se déplacer si lâcher. Il a donc (stocké) l'énergie "potentiel". Relâchez la balle, et une partie de son énergie potentielle devient «énergie cinétique» (énergie liée au mouvement). La balle se déplace. L'énergie potentielle sera ignoré dans cette discussion, cependant, son existence doit être noté, comme il est l'autre élément qui contribue à l'énergie totale.
L'énergie cinétique est non seulement un terme vague et descriptif. L'énergie cinétique peut être quantifiée. La formule qui ne soit
1) E = ½ mv²,
où "E" est l'énergie cinétique, m est la masse de la "boule de billard» ou molécule, et "v" est la vitesse à laquelle il se déplace.
Energie Total Kinetic
Molécules sous la plupart des cas se trouvent dans un très grand nombre. Par conséquent, la formule de l'énergie cinétique d'une substance devient apparente,
2) E (tot) = N₁MV₁² + N₂MV₂² + N₃MV₃² + ...
où il existe des molécules de vitesse (1) en quantité (1), les molécules d'une autre vitesse (2) existent en quantité (2), et ainsi de suite. Le E (tot) représente alors l'énergie cinétique totale de la collection complète des molécules.
A partir de l'équation ci-dessus, il est évident que si l'énergie cinétique d'un ensemble de molécules augmente, les augmentations globales de vitesse.
Energy Moyenne Kinetic
Même si les énergies des particules diffèrent les unes des autres, il est une chose simple pour déterminer l'énergie cinétique moyenne des particules. L'équation est,
E (av) = E (tot) / N (tot), ou,
3) E (av) = (N₁MV₁² + N₂MV₂² + N₃MV₃² + ...) / (N₁ + N₂ + N₃ + ...).
Relation avec Température
Pour augmenter l'énergie cinétique moyenne d'un ensemble de molécules (parfois appelé un «système»), la température du système augmente également.
Bien que les principes applicables aux matières solides, des liquides, des gaz et des plasmas de toutes sortes, que l'exemple de, un gaz monoatomique idéal sera considéré ici.
Théorie cinétique des gaz
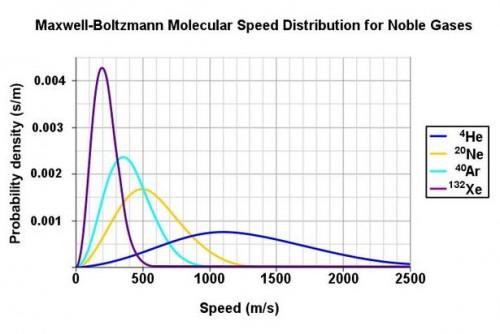
La théorie cinétique des gaz incorpore la "distribution de Boltzmann-Maxwell". Ceci décrit le nombre probable de molécules à une vitesse quelconque particulière dans un système avec une énergie cinétique moyenne donnée. Ainsi, il élucide trois équations ci-dessus.
Les mathématiques impliquées produit la relation,
4) E (av) = 3/2 kT,
où k = R / n et R est le gaz Idéal Constant, et n est le nombre d'Avogadro.
Énergie, Mouvement et de la température
Ainsi, la relation entre l'énergie, le mouvement moléculaire et la température, ainsi que les données mathématiques impliquées est expliquée. Augmentation de l'énergie, par exemple sous la forme de chaleur, augmente les mouvements moléculaires, qui à son tour fait monter la température d'un système, mesurable par un thermomètre.