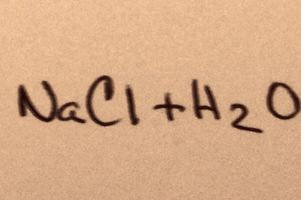Les bases

Lorsqu'un sel est ajouté à l'eau, il se dissout dans ses molécules constitutives jusqu'à ce que le plus grand nombre d'ions de sel que l'eau peut contenir flottent autour des molécules d'hydrogène et d'oxygène. Lorsque cela se produit, la solution est "saturée". À mesure que le sel est dissous, les ions sodium et de chlore percuter dans l'autre et se combinent de nouveau pour former des cristaux de sel. Cet événement est ce qu'on appelle "précipitation" parce que la matière solide qui est formé tombe au fond de l'eau. Les sels sont «hydrophiles», ce qui signifie qu'ils sont attirés par l'eau. Cette attraction facilite un type plus familier de précipitations; des gouttes de pluie se forment autour des cristaux de sel minute dans les nuages, en donnant la pluie son goût légèrement salé.
Electrolytes

Le sel ne conduit pas l'électricité particulièrement bien dans son état solide, mais dans un (liquide) état fondu, le sel forme une solution qui peut conduire l'électricité tout à fait bien. conductivité réelle dépend du sel qui est utilisé, mais ces liquides, appelées solutions électrolytiques, sont porteurs commodes pour les composés nécessaires à l'organisme humain. Les impulsions électriques produites par le cerveau, produisent de l'oxygène libre, qui est utilisé par le sang. Les molécules de sel sont séparés en électrolytes (sodium, potassium ou de calcium) et les chlorures en solution: le chlore est ventilé par le sang et les reins dans l'urine et les électrolytes sont distribués dans tout le système neuro-musculaire dans un processus que les athlètes savent que re -hydration.
Propriétés colligatives

Toute solution diffère de sa composition initiale, car l'ajout de molécules, même si elles ne forment pas de nouveaux composés, modifie le poids moléculaire du liquide et affecte ses propriétés. L'eau salée est plus dense que l'eau douce et gèle plus lentement. Comme l'eau gèle, cependant, le sel migre vers le liquide environnant, ce qui rend plus lourd, plus saturée, abaissant encore son point de congélation. A l'autre extrémité du spectre de la matière, l'eau salée plus dense nécessite plus de chaleur pour transformer en gaz, mais laisse à nouveau la majeure partie du sel derrière comme il évapore, ce qui rend un liquide plus dense. Comme la concentration de sel augmente dans le liquide, il nécessite plus de chaleur pour évaporer jusqu'à ce que finalement l'eau a disparu, laissant une couche de sel dans une casserole rouge. Les cuisiniers attendent d'ajouter du sel dans une marmite jusqu'à ce que l'eau est activement en ébullition pour laisser l'accumulation de chaleur dans l'eau de sorte que le sel ne cesse de bouillir. Ces qualités, appelées "propriétés colligatives,« aider les scientifiques à déterminer le poids moléculaire de l'eau salée. Si la masse du liquide, la pression atmosphérique, et le point d'ébullition du liquide peut être établi, les scientifiques peuvent soustraire le poids moléculaire de l'eau pour savoir quels sels sont présents.