Les isotopes sont des atomes d'un élément chimique avec un nombre variable de neutrons dans leurs noyaux. Tous les atomes d'un élément spécifié ont le même nombre de protons. Alors que les électrons sont présents dans de nombreux atomes, parce qu'ils ont peu de masse, seuls les protons et les neutrons sont considérés lors de la mesure de la masse d'un atome. Parce que le nombre de protons ne varie pas d'un atome à d'un élément, ce nombre est désigné le numéro atomique. Les neutrons peuvent varier d'un atome à, et sont calculés en comparant la masse d'un isotope à la masse standard d'un atome ne contenant que son nombre caractéristique de protons.
Instructions
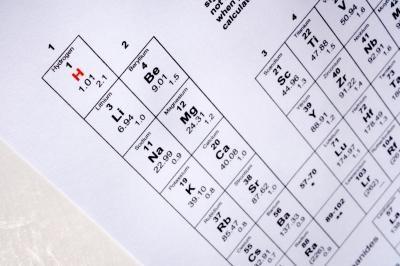
1 Recherchez l'élément pour l'isotope en question sur le tableau périodique. Notez le numéro atomique de cet élément. Le numéro atomique est généralement écrit en gros caractères relativement au-dessus du symbole chimique de l'élément. Ce chiffre vous indique le nombre de protons dans un atome de cet élément.
2 Déterminer le nombre de masse de l'isotope en examinant le nom de l'isotope. Un isotope particulier d'un élément est habituellement marqué avec le nom de l'élément et le nombre de masse pour cet isotope. Le nombre est soit en exposant au-dessus du symbole de l'élément ou par écrit comme ceci: le carbone-12. La présence d'un nombre de masse avec un élément désigne comme étant un isotope de cet élément.
3 Soustraire le numéro atomique de l'élément du numéro de masse de l'isotope pour obtenir le nombre de neutrons dans cet isotope. Par exemple, le numéro atomique à silicium (Si) est de 14. Un isotope particulier du silicium est le silicium-30. Pour trouver le nombre de neutrons dans cet isotope Si, soustraire le nombre atomique du nombre de masse: 30 - 14 = 16. Par conséquent, Silicon-30 a 16 neutrons et 14 protons.