ions polyatomiques se composent de deux ou plusieurs atomes liés de manière covalente et ont une charge nette. des ions polyatomiques qui contiennent de l'oxygène sont appelés oxyanions. Il est une bonne idée de se familiariser avec les ions polyatomiques communs puisque vous les rencontrez fréquemment. Si vous avez déjà couvert des structures de points de Lewis et VSEPR dans votre cours de chimie, vous pouvez dessiner des structures de points de Lewis pour ces ions et de prédire leurs formes en utilisant leurs formules moléculaires.
ion ammonium
L'ion ammonium est un acide faible et de l'acide conjugué de l'ammoniac. Sa formule moléculaire est NH4 +. Il est tétraédrique en forme avec quatre atomes d'hydrogène disposés symétriquement autour de l'atome d'azote central et a une charge nette de +1. En règle générale, les composés d'ammonium sont généralement solubles dans l'eau.
Sulfate / sulfite Ions
L'ion de sulfate a la SO4 formule moléculaire avec une charge nette de -2, tandis que l'ion sulfite a une formule moléculaire de SO3 et une charge nette de -2. L'ion sulfate est de forme tétraédrique, alors que l'ion sulfite a une forme pyramidale trigonale. des composés ioniques avec des sulfates sont généralement solubles dans l'eau, à l'exception du calcium, le strontium, le baryum, le plomb, le mercure et l'argent. L'ion sulfate est la base conjuguée de l'ion sulfate d'hydrogène, qui est la base conjuguée de l'acide sulfurique.
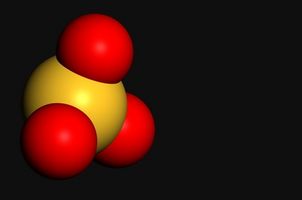
Phosphate
L'ion phosphate a la PO4 de formule moléculaire et une charge nette de -3. Il est tétraédrique en forme et est la base conjuguée d'un acide polyprotique, l'acide phosphorique. Les composés ioniques de phosphates sont généralement insolubles dans l'eau, à l'exception des composés des éléments du groupe 1 (les métaux alcalins) et de phosphate d'ammonium. les groupes phosphates sont particulièrement importants en biochimie; le squelette de l'ADN est formée à partir d'une chaîne sucre-phosphate et la synthèse de nucléoside-triphosphates est un moyen important pour les cellules pour stocker l'énergie et de la récolte.
Nitrates / nitrites Ions
L'ion nitrate NO3 a la formule moléculaire, tandis que l'ion nitrite NO2 a la formule moléculaire. Les deux ions ont une charge nette de -1. Nitrates et les nitrites sont solubles dans l'eau comme une règle générale. L'ion nitrate a une forme trigonale plane, tandis que l'ion nitrite a une forme angulaire ou plié; dans les deux cas l'atome d'azote est l'atome central.
Chlorates et perchlorates
Il y a quatre oxyanions communes qui contiennent du chlore, à savoir, l'hypochlorite, chlorite, chlorate et perchlorate. Leurs formules moléculaires sont (ClO) -, (ClO2) -2, (ClO3) -3 et (ClO4) -4, respectivement. Hypochlorite a une -1 accusation, chlorite a un -2 frais, chlorate a une -3 charge et perchlorate a une -4 responsable. En règle générale, les composés ioniques formés par ces ions sont généralement solubles dans l'eau.