Molarité est le nombre de moles par unité de volume. Une taupe est une mesure du nombre de molécules dans un échantillon. Parce que certaines équations sont écrites en moles au lieu de la densité, une conversion peut être préférable de travailler dans la densité directement. La raison pour laquelle les équations peuvent être écrites en moles est de permettre une utilisation plus large des équations, vous pouvez donc empêcher une constante de proportionnalité de la variable. Un exemple est la loi des gaz parfaits, PV = nRT, où n est le nombre de moles. Remplacement n / V avec une densité forcerait la constante de proportionnalité R varie entre gaz.
Définition de Mole
Un grain de beauté est une mesure d'une substance numériquement égale en grammes à son poids moléculaire ou de masse moléculaire. Par exemple, le poids moléculaire de l'hydrogène est 1.00794 unités de masse atomique (uma), de sorte qu'une mole d'hydrogène elles pèse 1.00794 grammes. Une mole d'oxygène pèse 15.9994 grammes. La raison pour laquelle les valeurs ne sont pas exactement égal à 1 ou 16 parce que le poids moléculaire est une moyenne sur les isotopes d'un élément.
Définition de Molarity
Molarité est une mesure de la concentration: moles de soluté par litre (L) du solvant. (Ce ne doit pas être confondu avec "molalité," qui est moles par kilogramme de solvant.) Molarity est représenté avec un capital M. Par exemple, 12.011 grammes de graphite dissous dans un litre d'eau seraient dit avoir une concentration de 1.0000M, ou une molarité de 1,0000.
Conversion
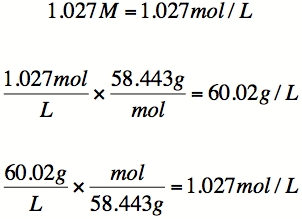
Une étape essentielle dans la conversion entre la densité et la molarité est d'avoir accès aux poids moléculaires des éléments. Heureusement, les tables périodiques ont tendance à eux, énumérés ci-dessous chaque symbole de l'élément comprennent.
Ensuite, le poids moléculaire du soluté doit être déterminée. Supposons que le soluté est le chlorure de sodium (NaCl). Le poids moléculaire de NaCl est 22,990 (Na) + 35,453 (Cl) = 58,443 uma.
Ainsi, si 30 g de NaCl ont été dissous dans une solution, le nombre de moles de soluté est de 30 g / (58.443g par mole) = 0.5133 mole.
Supposons qu'il y ait 500mL de solvant. Rappelez-vous que molarité est mesurée par litre (L) de solvant. Donc, la molarité est 0.5133 moles / 0.5L = 1.027M.
Conversion de retour à la densité est une question de la multiplication par (58.443g par mole) pour obtenir 60.02g / L.