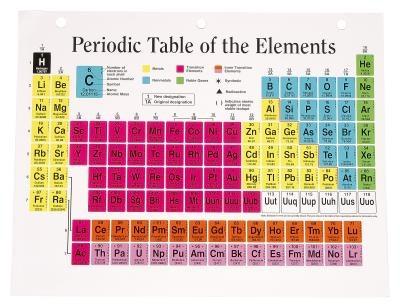
Un atome est la plus petite unité d'un élément. Les éléments sont des substances chimiquement simples qui ne peuvent être décomposés plus loin, mais peuvent être assemblés pour former des composés. Les éléments connus sont tous disposés sur le tableau périodique des éléments, en commençant par l'hydrogène dans la première place et se terminant par ununoctium dans la tache 118e. Les numéros les éléments sont répertoriés par sont connus comme leurs numéros atomiques. Un tableau périodique comprend également le poids atomique dans la zone d'affichage de l'élément.
Structure atomique
Atoms contiennent trois types de particules subatomiques: protons, neutrons et électrons. Les protons portent une charge positive, les neutrons une charge neutre et les électrons une charge négative. Les protons et les neutrons sont logés dans le noyau central de l'atome tandis que les électrons existent dans les coquilles de l'orbite à l'extérieur du noyau. Parce que les éléments ne sont pas une charge positive ou négative, les atomes doivent au sein d'un nombre égal de protons et d'électrons pour équilibrer au neutre.
Nombre atomique et atomique Poids
Le tableau périodique des éléments est agencé en fonction du nombre atomique parce que c'est la caractéristique la plus déterminante des éléments. Le numéro atomique est le nombre de protons, ce qui correspond également au nombre d'électrons. Par exemple, le krypton est marqué avec un numéro atomique de 36, ce qui signifie qu'il a 36 protons et 36 électrons.
Le nombre de neutrons dans un élément peut être calculé en utilisant son poids atomique indiqué. Autour du poids atomique au nombre entier le plus proche, réglez égal au nombre de protons, plus le nombre de neutrons et de résoudre pour la valeur inconnue. Pour le krypton, le poids atomique est 83,80. Round à 84 et égal à 36 + n: 84 = 36 + n. Soustraire 36 des deux côtés: 48 = neutrons.
Ions et Isotopes
Si le nombre d'électrons dans un atome est augmentée, l'atome devient chargé négativement. Si les électrons diminuent, l'atome prend une charge positive. Lorsque cela se produit, l'élément est représenté par son sigle chimique suivi par un signe plus ou moins. Par exemple, lorsque le sodium (Na) devient positif, il est écrit: Na +.
Si le nombre de neutrons changements, la charge de l'élément reste le même, mais il devient plus instable. Isotopes ont souvent des vies courtes en raison de leur instabilité. Les isotopes sont nommés en utilisant la même abréviation que l'élément, suivie d'un nombre qui représente le nombre de protons et du nombre de neutrons.
Changement de Protons
Si un élément est écrit avec un signe plus ou moins le suivant lorsque le nombre d'électrons changent et avec un tableau de bord et une somme de protons et de neutrons lorsque le nombre de neutrons changements, comment est un élément écrit si le nombre de protons changer?
Il n'a pas été écrit, car un changement dans le nombre de protons modifie l'élément. Par exemple, un atome ne peut être appelé un atome de krypton si elle a 36 protons. Le numéro atomique et le poids atomique d'un élément, deux traits définitoires importants, dépendent du nombre de protons séjournant même. Ajout d'un proton à krypton créerait le numéro 37 du tableau périodique, le rubidium.