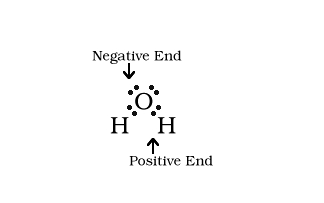
Moment dipolaire
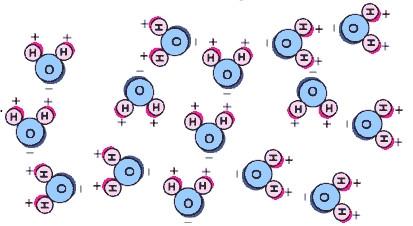
chlorure de sodium NaCl ou de sel est un composé ionique. Le réseau peut être rompu par l'eau parce que les molécules d'eau ont un moment dipolaire. Ce moment dipolaire provient des ions d'hydrogène dans l'eau qui empruntent chacune un électron de l'atome d'oxygène pour stabiliser sa coquille à deux électrons. Cela laisse quatre électrons de la couche électronique externe de l'oxygène étendu vers l'autre côté de telle sorte que les deux paires d'électrons et les atomes d'hydrogène forment un tétraèdre autour du noyau d'oxygène.
La dissolution du sel dans l'eau peut donc être comprise comme une force ionique dipôle, une attraction électrostatique compris en termes de la loi de Coulomb.
Qu'est-ce qu'une réaction chimique?
Lorsque le sel se dissout dans l'eau, il ne forme pas une liaison chimique forte avec les molécules d'eau afin de passer par une réaction chimique. Lorsque l'eau s'évapore, le sel est laissé derrière.
Un changement chimique est où les liens sont rompus et de nouvelles obligations sous forme, ce qui provoque un réarrangement des atomes dans de nouvelles molécules. Les liaisons moléculaires H2O ne sont pas cassées quand il attache aux ions Na et Cl en solution.
Les atomes de sodium et de chlore sont simplement attirés par les parties de la molécule d'eau chargées positivement et négativement, plus que l'autre.
Goût
Le goût du sel dissous dans l'eau est salée. La raison pour laquelle la séparation entre le sodium et le chlore n'a pas changé le goût du sel est parce que les ions sont séparés comment le sel est généralement un goût, dissous par l'humidité dans la bouche.
La clarté
Si le sel est complètement dissous, l'eau reste claire Si elle n'a pas tous dissous, l'eau va suspendre les petites particules de sel et apparaîtra trouble.
Évaporation
Lorsque l'eau s'évapore, le sel reste derrière. Les atomes de sodium et de chlore se rejoignent. son indique que le sel n'a pas modifié la structure moléculaire de l'eau, et par conséquent, n'a pas induit une réaction chimique.
Que le sel est laissé lors du chauffage de l'eau signifie que les molécules d'eau sont moins fortement attirés l'un vers l'autre que les ions présents dans la molécule de sel sont les uns aux autres. l'énergie cinétique vibrationnelle de molécules est ce que nous vivons sous forme de chaleur. Chauffage rend les molécules d'eau jiggle plus en plus vite jusqu'à ce que l'énergie cinétique surmonte leur énergie attrayante, et les molécules d'eau se détacher les unes des autres et de devenir un gaz. L'énergie cinétique suffisante pour évaporer l'eau ne suffit pas de séparer les ions sodium, peu importe leur évaporation.
Limite
Seulement tellement le sel peut être dissous dans un volume donné d'eau liquide car il n'y a qu'un nombre fini de points d'attraction sur les molécules d'eau pour les ions de sodium et de chlore pour attacher. Cette limite est appelée le point de saturation.