En chimie, le terme "dilution infinie» est un concept appliqué à l'étude de solvants et de solutés (substances dissoutes dans les solvants). Il est une méthode d'extrapolation utilisée pour tester si une propriété donnée d'une solution provient du soluté. La nature ésotérique de l'épreuve contraste avec la notoriété qu'il a reçu au cours des dernières décennies en raison de sa mauvaise utilisation occasionnelle dans le domaine de la médecine homéopathique.
Stratégie
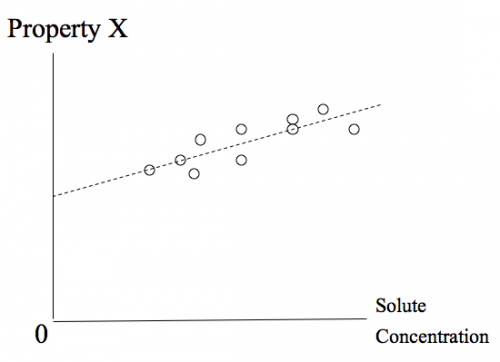
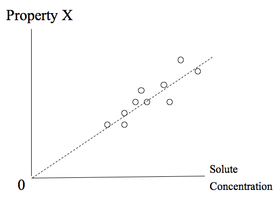
Infini dilution est un test par extrapolation, pas un concept physique. Le soluté est pas réellement réduit à une concentration nulle, pour des raisons pratiques. Au lieu de cela, une extrapolation, ou la limite, est déterminée à partir de points de diverses concentrations de soluté de données pour voir si une propriété donnée disparaîtrait à zéro concentration de soluté. Dans le cas contraire, la propriété est provoquée par le soluté. Sinon, il est considéré comme une preuve que l'effet observé est dû à autre chose que ce soluté spécifique.
Quelques définitions
Quelques définitions pour dilution infinie ont été mis en avant dans la littérature. On indique que la dilution infinie est le comportement particulier d'un mélange à deux substances, lorsque la concentration d'un composant se rapproche de la limite de 0 et l'autre se rapproche d'une fraction molaire de 1 (le second composant étant le solvant).
Une autre définition est: ce comportement particulier lorsque le mélange est suffisamment dilué que les interactions soluté-soluté sont négligeables.
Rôle dans la recherche d'une base de calcul
En dehors de tester si un soluté joue un rôle dans une propriété, la méthode de dilution infinie peut être utilisé pour un couple d'autres raisons.
A titre d'exemple, la solubilité du gaz dépend de la pression et de la température. En déterminant la solubilité du gaz dans la limite lorsque la concentration de soluté passe à zéro, une lecture de pression et de température indépendante de la base de la solubilité du gaz peut être déterminée. La base peut alors être modifiée pour la pression et la température de dépendance à des concentrations plus élevées. L'utilisation d'une base et des facteurs de modification distincts simplifie effectivement les calculs.
La recherche se fait aussi dans la gamme de dilution infinie, qui est, à des concentrations faibles, puisque la gamme est importante dans plusieurs industries. Par exemple, dans l'industrie environnementale, en éliminant les niveaux de pollution de trace peuvent nécessiter la connaissance des comportements de la solution à faible concentration. Purification dans l'industrie pharmaceutique exige également la connaissance du comportement dans cette gamme. L'industrie du caoutchouc est intéressé par le comportement des solvants car ils polymères de sortie.
questions de procédure
Mais pourquoi utiliser une dilution infinie du tout? Pourquoi ne pas simplement tester un solvant, sans le soluté dissous en elle?
Dans certains cas, plus d'un soluté est présent. Mais alors pourquoi ne pas simplement préparer un solvant avec seulement les autres solutés? Parce que les autres solutés peuvent changer eux-mêmes dans ledit soluté, pour atteindre l'équilibre dynamique. En d'autres termes, ils peuvent être sur des côtés opposés de la même équation chimique. Très peu de réactions chimiques se déroulent dans un seul sens; la plupart des réactions sont réversibles. Dès que certaines molécules de produit forment, la réaction inverse commence à se produire. Ou les autres solutés peuvent être nécessaires en quelque sorte.
Le point d'une expérience peut même pas être de déterminer le comportement à la limite de dilution, mais au lieu de déterminer une base de calcul, comme mentionné ci-dessus.
Parfois, il est simplement souhaitable d'être en mesure d'identifier et donc d'éliminer le bruit de fond des interactions solvant-solvant et d'une autre source pour soustraire à partir des calculs ultérieurs du comportement du soluté.
Dans l'ensemble, l'idée générale est que la situation est suffisamment complexe pour que l'élimination d'un seul soluté est pas une analyse suffisante. Un exemple ci-dessous illustre une telle complication.
Abuser
Dans le milieu de la recherche chimique, concepts subtils ne sont parfois pas traitées de manière adéquate, par exemple, l'utilisation excessive de l'extrapolation pour déterminer la nature des comportements à faible concentration ou en supposant une interaction ionique négligeable à une concentration suffisamment faible.
Les abus de dilution infinie recevant l'attention des médias, cependant, le centre autour de la communauté homéopathique. Pour plus d'un siècle, les membres de la communauté homéopathique ont vendu des dilutions de poisons, guidés par la "loi de similitude": ce qui produit des symptômes chez une personne saine peut guérir une personne malade avec les symptômes. Des dilutions multiples ont été trouvés pour réduire les effets secondaires, sans pour autant réduire l'efficacité de la substance. (Passées et praticiens actuels diluer parfois le poison tant que de dépasser ce qui est appelé la limite de dilution, au point où il est peu probable que les molécules de la substance d'origine restent --- littéralement une dilution infinie!)
La différence par rapport à la méthode de dilution infinie dans la chimie --- en dehors de diluer physiquement même au-delà de la limite de dilution, par opposition à l'aide de l'extrapolation --- est que ces praticiens croient que la constance du bénéfice après dilution lourde signifie le solvant eau / alcool "appris "propriétés de poison / ingrédient actif. Un chimiste conclurait le contraire: que la substance active n'a pas eu un avantage, et que la recherche de la source d'avantages serait trouvé ailleurs, par exemple, le solvant, un peu d'impureté ou l'effet placebo. L'incapacité des personnes à l'extérieur de l'homéopathie pour reproduire les résultats bénéfiques de ces potions suggère une quatrième possibilité.